
产品中心
Product Center





药用辅料预胶化淀粉 原厂包装
 产品简介
产品简介
| 货号 | 00225 | 规格 | 500g 25kg |
|---|---|---|---|
| 供货周期 | 现货 | 主要用途 | 崩解剂 填充剂 |
| 应用领域 | 医疗卫生 |
药用辅料预胶化淀粉 原厂包装
药用辅料预胶化淀粉 原厂包装
重金属 取炽灼残渣项下遗留的残渣,依法检查(通则0821第二法),含重金属不得过百万分之二十。 微生物限度 取本品,依法检查(通则1105与通则1106),每1g供试品中需氧菌总数不得过103cfu,霉菌和酵母菌总数不得过102cfu,不得检出大肠埃希菌。 【类别】药用辅料,填充剂、崩解剂和黏合剂等。 【贮藏】密封保存。 【标示】应标明本品的淀粉来源,应标明粒度与粒度分布、水中溶解物(可按所附方法检测)的标示值。 水中溶解物 精密量取水100ml,置烧杯中,取本品2.0g,精密称定,边磁力搅拌边缓缓加入上述烧杯中,继续搅拌10分钟,取该分散溶液,以每分钟3000转的转速离心15分钟。精密量取上清液25ml,置经120℃干燥至恒重的蒸发皿中,水浴蒸干,在120℃干燥4小时,按下式计算(以干燥品计)水中溶解物(%)。 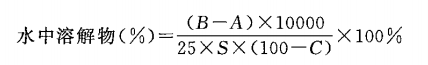 式中 A为蒸发皿的初始重量,g; B为蒸发皿的终重量,g; C为本品的干燥失重,%; S为取样量,g。 注:本品有引湿性,本品在水中溶胀。
式中 A为蒸发皿的初始重量,g; B为蒸发皿的终重量,g; C为本品的干燥失重,%; S为取样量,g。 注:本品有引湿性,本品在水中溶胀。
资料要求
1、申报资料按规定的资料顺序编号,按编号分别装订,申报资料首页为申报资料目录。
2、申报资料应使用A4纸打印,内容完整、清楚,不得涂改。
3、资料封面应包含以下信息:药品名称、资料项目编号、项目名称、申请机构姓名、电话、地址,试验资料完成机构名称、主要完成人、参加人、电话、原始资料保存地点。并须加盖各机构公章。
4、资料按套装入档案袋,档案袋封面注明:申请分类、注册分类、药品名称、本袋所属第X套第X袋每套共X袋、原件/复印件、申请机构、电话。
5、注册申请报送2套完整申请资料(其中至少1套为原件)和1套综述资料(可为复印件),各袋均应包含1份申请表。